石灰新产业7|二氧化钙的生产与新工艺应用
2024-07-29 08:55:34 来源:石灰窑生态圈
 石灰新产业7|二氧化钙的生产与新工艺应用
一、过氧化钙的传统合成工艺
二氧化钙即过氧化钙,目前,传统的过氧化钙生产方法按所含钙原料,可分为氢氧化钙法、氧化钙法和钙盐法(氯化钙或碳酸钙)等生产方法。
1.1、氢氧化钙法
氢氧化钙法有又可分为传统法,空气阴极法和喷雾干燥法。
1.1. 1 传统法
传统法主要是利用含钙的化合物与过氧化物发生氧化还原反应来制备湿的过氧化钙,然后再经过分离,脱水便可得过氧化钙产品。
有关过氧化钙的制备和放氧反应为:
Ca( OH ) 2 + H 2 O 2 → CaO 2 + 2H 2 O ( 1)
CaO 2 + H 2 O→ Ca( OH)2 + O 2 ( 2)
在这两个反应中,其中反应(1)用于过氧化钙的制备,反应(2)是过氧化钙释放活性氧的机理。
(1)、不用添加剂法
以氢氧化钙和过氧化物来制备过氧化钙:过氧化物通常是过氧化氢,Ca (OH) 2 造价较低,所以主要的原料成本来自过氧化氢,而过氧化氢在碱性条件下分解很快,为了降低其分解速度,减少成本,常采用浓的Ca( OH ) 2 悬浮液与H2O 2在常温下反应制备过氧化钙。
以氢氧化钙和双氧水为原料合成过氧化钙:首先将反应混合物(浆料)冷却。再加进氧化钙去干燥此浆料,同时生成过氧化钙产品,如需得无水过氧化钙,则需进一步干燥。若用浓缩的氢氧化钙水悬液,在冷却和不断搅拌下与浓缩的双氧水反应,反应结束后所得混合物直接喷雾、干燥,不需分离、提纯等过程,也可得到分散性好,粒度均匀的无水过氧化钙产品。
(2)、用添加剂法
用氢氧化钙制备过氧化钙:通过加入新型稳定剂磷酸铵合成过氧化钙,在用氢氧化钙合成过氧化钙时,以磷酸二氢钠为稳定剂。该法不仅设备简单、操作方便、与传统的低温合成法相比,在大大降低了能耗与成本的同时,也带来了高品质的产品,而且无污染。稳定性好 。
用氢氧化钙与过氧化氢反应制备过氧化钙。不加稳定剂时,一般需要在0~5 ℃下进行反应;加入稳定剂后,反应可在室温下进行。由于氢氧化钙微溶于水,也有使其先在铵盐溶液中溶解生成氨络合物,然后利用络合物解离出的Ca 2 +与H2O2反应,生成过氧化钙的制备方法。
1.1. 2 空气阴极法
空气阴极法制备过氧化钙的工艺,实质上是把过氧化钙的合成与过氧化氢的生产结合起来,通过降低关键原料过氧化氢的成本,来降低*终产品过氧化钙的生产成本。其基本原理是,在碱性条件下,空气中的氧和水在特制的阴极上直接还原得过氧化氢,然后加入氢氧化钙进行反应制得产品过氧化钙
阴极:O 2 + H 2 O + 2e - → HO - 2 +OH -
阳极: 2OH - → 2e - +H 2 O + 1 /2O 2
此法生产能力比较小,只适用于小规模生产。
1.1. 3 喷雾干燥法
将按一定比例配制好的过氧化氢和氢氧化钙的水悬浊液通过一个有多层圆心通道的喷嘴,进行气流雾化反应,可直接制得过氧化钙产品,气源是脱除水、油及二氧化碳的干燥氮气,反应压力为0. 2MPa,反应式如下:
Ca (OH) 2 +H 2 O 2 CaO 2 + 2H 2 O
此法工艺简单,产品纯度高,能耗低,能连续生产。但该法操控难度较大,设备、管道易结垢堵塞,且存在爆炸的危险性
1.2、氧化钙法
以氧化钙和双氧水为原料,通过添加稳定剂,可实现过氧化钙的常温合成。通过对反应时间、稳定剂的用量、原料配比等因素对过氧化钙的合成、纯度和产率的影响情况,可实现*佳工艺条件。
采用氧化钙为原料直接与双氧水反应制备过氧化钙。加入稳定剂可以使反应在常温下进行得到CaO2·8H2O,进行干燥处理。并且反应中没有铵盐的加入。新工艺具有反应原料少,产品纯度高,没有外加杂质的引入和三废排放,是一种清洁的环保生产工艺。
除此之外还有用氧化钙为钙源制备过氧化钙的其它方法。如:通过以氧化钙和过氧化氢为主要原料,探索在常温下适当添加碱为稳定剂合成过氧化钙的新工艺及*佳工艺条件。此方法通过加入适当的碱稳定剂探索了一条常温水相法合成过氧化钙的新工艺,所得到的过氧化钙产品产率和纯度较高,稳定性好。与传统的低温合成相比,不仅降低了能量消耗和成本,而且该法操作简便,装置简单易控制,为过氧化钙的工业化生产及应用创造了条件。该方法的改进与传统的低温合成方法相比,更有利于合成过氧化钙的生产及推广和应用。
1.3、钙盐法
1.3. 1 氯化钙
以氯化钙和双氧水为主要原料,可实现过氧化钙的制备,通过对反应时间、反应温度、稳定剂的用量、种类、投料配比等因素对过氧化钙的合成的影响等操控,确定过氧化钙合成的*佳工艺条件。
该方法制备的过氧化钙产品含量和产率都达到了60%以上,各项指标都达到了理想要求。
在用氯化钙与过氧化氢制备过氧化钙时常常加入氨水,加氨水的目的是中和反应过程中产生的酸,CaCl2在氨水介质中先生成配合物,然后再与过氧化氢反应生成CaO 2·8H 2 O ,经干燥脱水得无水CaO 2。 反应式如下:
CaCl 2·6H 2 O + 2NH 3 →Ca (NH 3 ) 2Cl 2·6H 2 O
Ca(NH 3 ) 2 Cl 2·6H 2 O+2H 2 O 2 →2NH 4 Cl +CaO 2·8H 2 O
CaO 2·8H 2 O →CaO 2 + 8H 2 O
该方法为液—液反应,反应物能充分混合,但需要加入氨水中和副产物HCl,这会使CaO 2产品存在氨的气味而难以用作食品添加剂,而且铵盐的存在会使CaO 2分解而造成有效成分含量的降低。如果低温下反应,可降低H2O2和CaO2 的分解损失,提高H 2 O 2的利用率和产品中CaO 2 的含量。但在低温下需要制冷设备,其工艺复杂且成本高。目前普遍采用加入稳定剂在常温下制备的方法,以减少过氧化钙的分解损失,提高其利用率,并降低成本。
1.3. 2 碳酸钙
大理石(或石灰石)的主要成分是碳酸钙,还含有其他金属离子(锰, 铁等)及不溶性杂质。通过以大理石,过氧化氢为原料,制备过氧化钙,将提纯后的碳酸钙溶于适量的盐酸中,在低温和碱性条件下,与过氧化氢反应制得过氧化钙。
钙盐法,氢氧化钙法反应一般控制在0 - 5 ℃进行,均生成 CaO 2·8H 2O。钙盐法生产过氧化钙,产品质量较高,但成本高些;氢氧化钙法成本较低,但产品质量较低。这两种方法均可通过在合成时添加适当的活化剂以得到不同程度的克服。
二、过氧化钙的新生产工艺研究
传统的氯化钙法和氢氧化钙法的优点是工艺过程和设备较简单,技术较成熟,适合于小规模生产;共同缺点是采用稀溶液生产,大量母液中过氧化氨分解损失大,其产品收率和Ca02含量不可能达到很高,Ca02含量一般仅为50%~60%。喷雾于燥法则采用高浓度过氧化氢和固体(或浆状)氢氧化钙直接进行反应,并采用喷雾法脱水干燥,物料中水分少,可减少过氧化氢的分解损失。但该法的问题是控制难度较大,设备、管道易结垢堵塞,且存在爆炸的危险性。另外,国内缺少高浓度的过氧化氢。
而且,过氧化钙的合成方法虽然有很多种,但是多数是在低温下反应,需要制冷设备,工艺复杂,成本高。为了简化工艺,降低成本,提高安全性,唐山金泉冶化科技产业集团旗下“唐山金泉冶化科技产业有限公司技术中心”在传统Ca(0H)2-NHC1-H02合成法工艺的基础上,对其常温下制备过氧化钙的工艺条件进行了研究和应用。该项工艺采用在反应物料中加入一种稳定剂,减少过氧化氢的分解损失,取得了很好的效果。该法操作简单,产品收率高,稳定性好。
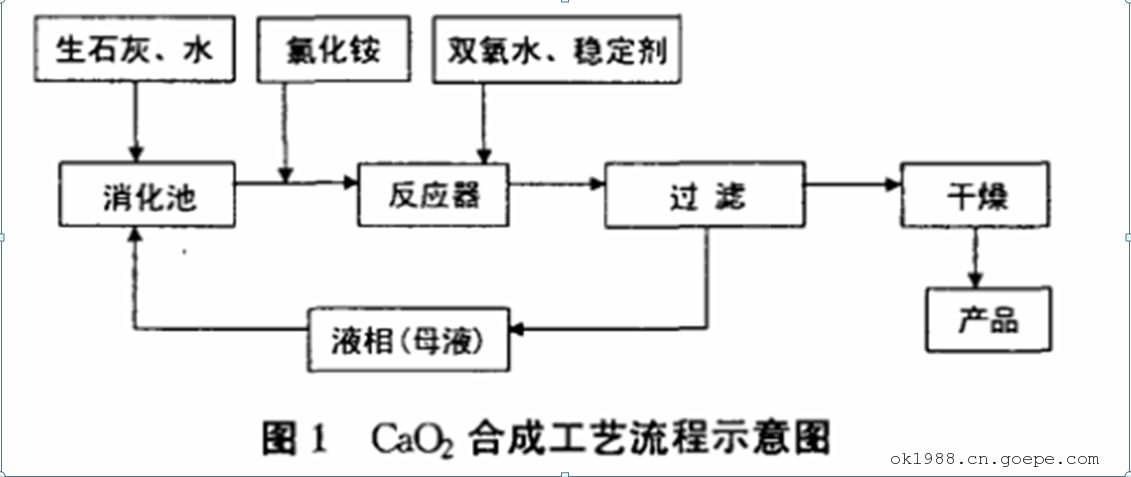
2.1 、CaO2的工艺流程
生石灰与母液和补充水在消化池中消化成石灰乳[Ca(OH)2悬浮液],氯化铵固体加水溶解后,加入石灰乳中。然后将其加入反应器中,与双氧水反应生成过氧化钙,为了降低过氧化氢和反应生成的过氧化钙的分解,其间加入稳定剂。反应一定时间后,将生成的 Ca02料浆过滤分离,其固相再经干燥即为产品,液相(母液)返回消化池,循环使用。
2.2、 CaO2的合成原理
氢氧化钙在铵盐溶液中生成络合物,氨络合物会解离:
Ca(OH)2+ 2NH4CI→Ca(NH3)2·2H2O→CaCl2+ 2NH3·H2O (1)
游离的 Ca2+与氧化剂H2O2发生化学反应,生成难溶于水的过氧化钙;
Ca2++2H202→Ca02+2H20 (2)
副反应:
H2O2→H2O+ [O] (3)
2[0] →02↑ (4)
2Ca02+2H20→2Ca(OH)2+02↑ (5)
2.3、CaO2的原料
双氧水:工业品,含量(含H202)为27%~30%;
生石灰:工业品;
氯化铵:工业品,纯度98%;
稳定剂:自配。
2.4、影响过氧化钙的常温合成的因素
2.4.1 反应温度的影响
温度是决定反应速度的重要因素,升高温度有利于反应(3)和(4),不利于反应(2)。反应(2)将导致活性氧的损失,反应温度在 25~29℃时,H2O2利用率仅为70%-80%。从理论上讲,低温反应,可降低 H202和 Ca02的分解损失,可提高产品中 CaO2的含量。反应温度越低,H2O2利用率*高。过氧化钙的合成就应该在低温下进行,需要制冷设备,工艺复杂。成本高。为了简化工艺,降低成本,采用加入稳定剂在常温条件下尽可能提高 H2O2的利用率。
在生产过程中,观察到低温反应时,放出的气泡(氧气)确比常温下少,所得湿产品Ca02的含量也较高,但在干燥过程中,放出较多的氧气,活性氧的损失较大,说明 Ca02分解现象较严重。加入稳定剂后,常温下反应所得湿物料产品,在干燥过程中较稳定。因此,常温下反应所得产品中Ca02的含量比低温下反应还高。从生产结果看,选择常温(20~25℃)的反应条件是可行的。
2.4.2 、反应时间的影响
反应时间也是决定 H202利用率的重要因素,反应时间不宜过短,也不宜过长。过短,反应不完全;过长,则增加产物 CaO2在液相中的停留时间而增加分解损失。当反应温度 20~25℃,Ca(OH)2过量数 45%~50%,稳定剂用量6%,及其它条件不变时,随着反应时间的增加H2O2利用率逐渐降低。这是因为反应时间少于15min 时,反应生成 CaO2速度远大于 CaO2分解速度,CaO2浓度渐上升,当反应时间在15~20min 时反应生成速度等于分解速度,CaO2浓度开始下降,导致 H2O2利用率降低。因此,选择投料完毕后反应 15~20min是适宜的,此时,H2O2利用率*高>90%,过氧化钙的含量>70%。
2.4.3 稳定剂的影响
稳定剂的作用是在常温下降低反应(3)的速度使之与反应(2)的速度相适应。同时可抑制反应(4)的进行。从而提高 H2O2的利用率。当反应温度 20~25℃,Ca(OH)2过量数45%~50%,反尖时间15~20min,及其它条件不变时。改变稳定剂用量,随着稳定剂浓度的提高,H2O2利用率逐渐增加,当浓度>6%时(以H2O2的质量分数计),H2O2利用率基本保持不变。因此,选用稳定剂*佳浓度为6%。此时,H202利用率*高>90%,过氧化钙的含量>70%。
另外,稳定剂的加料方式也应注意,不宜直接加人到石灰乳中,而是加入到双氧水中较好,以免降低其稳定效果。
2.4.4、 氢氧化钙过量数的影响
根据反应动力学原理,增加Ca(OH)2的用量,反应(4)的速度降低,从而可提高H2O2的利用率。根据反应(2),以 H202为基准,Ca(OH)2过量0~60%,稳定剂6%,反应时间 15min,及其它条件不变时,随着 Ca(OH)2过量数的增加,反应(2)速度增加,H202利用率也随之提高,过量50%时,H202利用率*高。因此,Ca(OH)2过量45%~50%,此时,H202利用率*高>90%,过氧化钙的含量>70%。
2.4.5、母液循环对生产工艺的影响
过氧化钙在铵盐溶液中有一定的溶解性,一次反应,产品收率只有70%左右。采用母液循环,由于CaO2在 NH4+中溶解已达饱和,新生成的 CaO2能完全沉淀,从而提高产率。另外,母液循环还可以少加氯化铵,减少了原材料的消耗,降低生产成本。通过生产及实验得知:母液循环3次,产品的平均收率可达90%以上。但是,由于生产过程中,水量在不断增加,若继续全部循环,会增加设备运转负荷,降低生产能力。因此,建议母液部分循环,保持生产过程中的物料平衡。
三、总 结
在过氧化钙的合成方法中, 钙盐法和传统的氢氧化钙法的工艺过程和设备比较简单,技术比较成熟,更适合于小规模生产。钙盐法和传统的氢氧化钙法、空气阴极法的共同缺点是采用稀溶液生产,大量母液中过氧化氢分解损失严重,其产品收率和 CaO2 含量不可能生成过氧化钙的分解,但通过加入稳定剂,基本上解决了稀溶液法生产过程中产品 CaO2 含量和收率不能兼顾这一矛盾,综上表明稳定剂的效果良好。
而且,唐山金泉冶化科技产业有限公司提出的上述新工艺以生石灰和双氧水为原料,通过添加稳定剂,实现了过氧化钙的常规合成。确定了反应时间、稳定剂用量、氢氧化钙过量数等因素对过氧化氢利用率和产品纯度的影响,确定了*佳工艺条件,实现了过氧化钙在常温下的合成。
资料整理编辑:
《石灰产业》编辑部
2024年07月29日
石灰新产业7|二氧化钙的生产与新工艺应用
一、过氧化钙的传统合成工艺
二氧化钙即过氧化钙,目前,传统的过氧化钙生产方法按所含钙原料,可分为氢氧化钙法、氧化钙法和钙盐法(氯化钙或碳酸钙)等生产方法。
1.1、氢氧化钙法
氢氧化钙法有又可分为传统法,空气阴极法和喷雾干燥法。
1.1. 1 传统法
传统法主要是利用含钙的化合物与过氧化物发生氧化还原反应来制备湿的过氧化钙,然后再经过分离,脱水便可得过氧化钙产品。
有关过氧化钙的制备和放氧反应为:
Ca( OH ) 2 + H 2 O 2 → CaO 2 + 2H 2 O ( 1)
CaO 2 + H 2 O→ Ca( OH)2 + O 2 ( 2)
在这两个反应中,其中反应(1)用于过氧化钙的制备,反应(2)是过氧化钙释放活性氧的机理。
(1)、不用添加剂法
以氢氧化钙和过氧化物来制备过氧化钙:过氧化物通常是过氧化氢,Ca (OH) 2 造价较低,所以主要的原料成本来自过氧化氢,而过氧化氢在碱性条件下分解很快,为了降低其分解速度,减少成本,常采用浓的Ca( OH ) 2 悬浮液与H2O 2在常温下反应制备过氧化钙。
以氢氧化钙和双氧水为原料合成过氧化钙:首先将反应混合物(浆料)冷却。再加进氧化钙去干燥此浆料,同时生成过氧化钙产品,如需得无水过氧化钙,则需进一步干燥。若用浓缩的氢氧化钙水悬液,在冷却和不断搅拌下与浓缩的双氧水反应,反应结束后所得混合物直接喷雾、干燥,不需分离、提纯等过程,也可得到分散性好,粒度均匀的无水过氧化钙产品。
(2)、用添加剂法
用氢氧化钙制备过氧化钙:通过加入新型稳定剂磷酸铵合成过氧化钙,在用氢氧化钙合成过氧化钙时,以磷酸二氢钠为稳定剂。该法不仅设备简单、操作方便、与传统的低温合成法相比,在大大降低了能耗与成本的同时,也带来了高品质的产品,而且无污染。稳定性好 。
用氢氧化钙与过氧化氢反应制备过氧化钙。不加稳定剂时,一般需要在0~5 ℃下进行反应;加入稳定剂后,反应可在室温下进行。由于氢氧化钙微溶于水,也有使其先在铵盐溶液中溶解生成氨络合物,然后利用络合物解离出的Ca 2 +与H2O2反应,生成过氧化钙的制备方法。
1.1. 2 空气阴极法
空气阴极法制备过氧化钙的工艺,实质上是把过氧化钙的合成与过氧化氢的生产结合起来,通过降低关键原料过氧化氢的成本,来降低*终产品过氧化钙的生产成本。其基本原理是,在碱性条件下,空气中的氧和水在特制的阴极上直接还原得过氧化氢,然后加入氢氧化钙进行反应制得产品过氧化钙
阴极:O 2 + H 2 O + 2e - → HO - 2 +OH -
阳极: 2OH - → 2e - +H 2 O + 1 /2O 2
此法生产能力比较小,只适用于小规模生产。
1.1. 3 喷雾干燥法
将按一定比例配制好的过氧化氢和氢氧化钙的水悬浊液通过一个有多层圆心通道的喷嘴,进行气流雾化反应,可直接制得过氧化钙产品,气源是脱除水、油及二氧化碳的干燥氮气,反应压力为0. 2MPa,反应式如下:
Ca (OH) 2 +H 2 O 2 CaO 2 + 2H 2 O
此法工艺简单,产品纯度高,能耗低,能连续生产。但该法操控难度较大,设备、管道易结垢堵塞,且存在爆炸的危险性
1.2、氧化钙法
以氧化钙和双氧水为原料,通过添加稳定剂,可实现过氧化钙的常温合成。通过对反应时间、稳定剂的用量、原料配比等因素对过氧化钙的合成、纯度和产率的影响情况,可实现*佳工艺条件。
采用氧化钙为原料直接与双氧水反应制备过氧化钙。加入稳定剂可以使反应在常温下进行得到CaO2·8H2O,进行干燥处理。并且反应中没有铵盐的加入。新工艺具有反应原料少,产品纯度高,没有外加杂质的引入和三废排放,是一种清洁的环保生产工艺。
除此之外还有用氧化钙为钙源制备过氧化钙的其它方法。如:通过以氧化钙和过氧化氢为主要原料,探索在常温下适当添加碱为稳定剂合成过氧化钙的新工艺及*佳工艺条件。此方法通过加入适当的碱稳定剂探索了一条常温水相法合成过氧化钙的新工艺,所得到的过氧化钙产品产率和纯度较高,稳定性好。与传统的低温合成相比,不仅降低了能量消耗和成本,而且该法操作简便,装置简单易控制,为过氧化钙的工业化生产及应用创造了条件。该方法的改进与传统的低温合成方法相比,更有利于合成过氧化钙的生产及推广和应用。
1.3、钙盐法
1.3. 1 氯化钙
以氯化钙和双氧水为主要原料,可实现过氧化钙的制备,通过对反应时间、反应温度、稳定剂的用量、种类、投料配比等因素对过氧化钙的合成的影响等操控,确定过氧化钙合成的*佳工艺条件。
该方法制备的过氧化钙产品含量和产率都达到了60%以上,各项指标都达到了理想要求。
在用氯化钙与过氧化氢制备过氧化钙时常常加入氨水,加氨水的目的是中和反应过程中产生的酸,CaCl2在氨水介质中先生成配合物,然后再与过氧化氢反应生成CaO 2·8H 2 O ,经干燥脱水得无水CaO 2。 反应式如下:
CaCl 2·6H 2 O + 2NH 3 →Ca (NH 3 ) 2Cl 2·6H 2 O
Ca(NH 3 ) 2 Cl 2·6H 2 O+2H 2 O 2 →2NH 4 Cl +CaO 2·8H 2 O
CaO 2·8H 2 O →CaO 2 + 8H 2 O
该方法为液—液反应,反应物能充分混合,但需要加入氨水中和副产物HCl,这会使CaO 2产品存在氨的气味而难以用作食品添加剂,而且铵盐的存在会使CaO 2分解而造成有效成分含量的降低。如果低温下反应,可降低H2O2和CaO2 的分解损失,提高H 2 O 2的利用率和产品中CaO 2 的含量。但在低温下需要制冷设备,其工艺复杂且成本高。目前普遍采用加入稳定剂在常温下制备的方法,以减少过氧化钙的分解损失,提高其利用率,并降低成本。
1.3. 2 碳酸钙
大理石(或石灰石)的主要成分是碳酸钙,还含有其他金属离子(锰, 铁等)及不溶性杂质。通过以大理石,过氧化氢为原料,制备过氧化钙,将提纯后的碳酸钙溶于适量的盐酸中,在低温和碱性条件下,与过氧化氢反应制得过氧化钙。
钙盐法,氢氧化钙法反应一般控制在0 - 5 ℃进行,均生成 CaO 2·8H 2O。钙盐法生产过氧化钙,产品质量较高,但成本高些;氢氧化钙法成本较低,但产品质量较低。这两种方法均可通过在合成时添加适当的活化剂以得到不同程度的克服。
二、过氧化钙的新生产工艺研究
传统的氯化钙法和氢氧化钙法的优点是工艺过程和设备较简单,技术较成熟,适合于小规模生产;共同缺点是采用稀溶液生产,大量母液中过氧化氨分解损失大,其产品收率和Ca02含量不可能达到很高,Ca02含量一般仅为50%~60%。喷雾于燥法则采用高浓度过氧化氢和固体(或浆状)氢氧化钙直接进行反应,并采用喷雾法脱水干燥,物料中水分少,可减少过氧化氢的分解损失。但该法的问题是控制难度较大,设备、管道易结垢堵塞,且存在爆炸的危险性。另外,国内缺少高浓度的过氧化氢。
而且,过氧化钙的合成方法虽然有很多种,但是多数是在低温下反应,需要制冷设备,工艺复杂,成本高。为了简化工艺,降低成本,提高安全性,唐山金泉冶化科技产业集团旗下“唐山金泉冶化科技产业有限公司技术中心”在传统Ca(0H)2-NHC1-H02合成法工艺的基础上,对其常温下制备过氧化钙的工艺条件进行了研究和应用。该项工艺采用在反应物料中加入一种稳定剂,减少过氧化氢的分解损失,取得了很好的效果。该法操作简单,产品收率高,稳定性好。
2.1 、CaO2的工艺流程
生石灰与母液和补充水在消化池中消化成石灰乳[Ca(OH)2悬浮液],氯化铵固体加水溶解后,加入石灰乳中。然后将其加入反应器中,与双氧水反应生成过氧化钙,为了降低过氧化氢和反应生成的过氧化钙的分解,其间加入稳定剂。反应一定时间后,将生成的 Ca02料浆过滤分离,其固相再经干燥即为产品,液相(母液)返回消化池,循环使用。
2.2、 CaO2的合成原理
氢氧化钙在铵盐溶液中生成络合物,氨络合物会解离:
Ca(OH)2+ 2NH4CI→Ca(NH3)2·2H2O→CaCl2+ 2NH3·H2O (1)
游离的 Ca2+与氧化剂H2O2发生化学反应,生成难溶于水的过氧化钙;
Ca2++2H202→Ca02+2H20 (2)
副反应:
H2O2→H2O+ [O] (3)
2[0] →02↑ (4)
2Ca02+2H20→2Ca(OH)2+02↑ (5)
2.3、CaO2的原料
双氧水:工业品,含量(含H202)为27%~30%;
生石灰:工业品;
氯化铵:工业品,纯度98%;
稳定剂:自配。
2.4、影响过氧化钙的常温合成的因素
2.4.1 反应温度的影响
温度是决定反应速度的重要因素,升高温度有利于反应(3)和(4),不利于反应(2)。反应(2)将导致活性氧的损失,反应温度在 25~29℃时,H2O2利用率仅为70%-80%。从理论上讲,低温反应,可降低 H202和 Ca02的分解损失,可提高产品中 CaO2的含量。反应温度越低,H2O2利用率*高。过氧化钙的合成就应该在低温下进行,需要制冷设备,工艺复杂。成本高。为了简化工艺,降低成本,采用加入稳定剂在常温条件下尽可能提高 H2O2的利用率。
在生产过程中,观察到低温反应时,放出的气泡(氧气)确比常温下少,所得湿产品Ca02的含量也较高,但在干燥过程中,放出较多的氧气,活性氧的损失较大,说明 Ca02分解现象较严重。加入稳定剂后,常温下反应所得湿物料产品,在干燥过程中较稳定。因此,常温下反应所得产品中Ca02的含量比低温下反应还高。从生产结果看,选择常温(20~25℃)的反应条件是可行的。
2.4.2 、反应时间的影响
反应时间也是决定 H202利用率的重要因素,反应时间不宜过短,也不宜过长。过短,反应不完全;过长,则增加产物 CaO2在液相中的停留时间而增加分解损失。当反应温度 20~25℃,Ca(OH)2过量数 45%~50%,稳定剂用量6%,及其它条件不变时,随着反应时间的增加H2O2利用率逐渐降低。这是因为反应时间少于15min 时,反应生成 CaO2速度远大于 CaO2分解速度,CaO2浓度渐上升,当反应时间在15~20min 时反应生成速度等于分解速度,CaO2浓度开始下降,导致 H2O2利用率降低。因此,选择投料完毕后反应 15~20min是适宜的,此时,H2O2利用率*高>90%,过氧化钙的含量>70%。
2.4.3 稳定剂的影响
稳定剂的作用是在常温下降低反应(3)的速度使之与反应(2)的速度相适应。同时可抑制反应(4)的进行。从而提高 H2O2的利用率。当反应温度 20~25℃,Ca(OH)2过量数45%~50%,反尖时间15~20min,及其它条件不变时。改变稳定剂用量,随着稳定剂浓度的提高,H2O2利用率逐渐增加,当浓度>6%时(以H2O2的质量分数计),H2O2利用率基本保持不变。因此,选用稳定剂*佳浓度为6%。此时,H202利用率*高>90%,过氧化钙的含量>70%。
另外,稳定剂的加料方式也应注意,不宜直接加人到石灰乳中,而是加入到双氧水中较好,以免降低其稳定效果。
2.4.4、 氢氧化钙过量数的影响
根据反应动力学原理,增加Ca(OH)2的用量,反应(4)的速度降低,从而可提高H2O2的利用率。根据反应(2),以 H202为基准,Ca(OH)2过量0~60%,稳定剂6%,反应时间 15min,及其它条件不变时,随着 Ca(OH)2过量数的增加,反应(2)速度增加,H202利用率也随之提高,过量50%时,H202利用率*高。因此,Ca(OH)2过量45%~50%,此时,H202利用率*高>90%,过氧化钙的含量>70%。
2.4.5、母液循环对生产工艺的影响
过氧化钙在铵盐溶液中有一定的溶解性,一次反应,产品收率只有70%左右。采用母液循环,由于CaO2在 NH4+中溶解已达饱和,新生成的 CaO2能完全沉淀,从而提高产率。另外,母液循环还可以少加氯化铵,减少了原材料的消耗,降低生产成本。通过生产及实验得知:母液循环3次,产品的平均收率可达90%以上。但是,由于生产过程中,水量在不断增加,若继续全部循环,会增加设备运转负荷,降低生产能力。因此,建议母液部分循环,保持生产过程中的物料平衡。
三、总 结
在过氧化钙的合成方法中, 钙盐法和传统的氢氧化钙法的工艺过程和设备比较简单,技术比较成熟,更适合于小规模生产。钙盐法和传统的氢氧化钙法、空气阴极法的共同缺点是采用稀溶液生产,大量母液中过氧化氢分解损失严重,其产品收率和 CaO2 含量不可能生成过氧化钙的分解,但通过加入稳定剂,基本上解决了稀溶液法生产过程中产品 CaO2 含量和收率不能兼顾这一矛盾,综上表明稳定剂的效果良好。
而且,唐山金泉冶化科技产业有限公司提出的上述新工艺以生石灰和双氧水为原料,通过添加稳定剂,实现了过氧化钙的常规合成。确定了反应时间、稳定剂用量、氢氧化钙过量数等因素对过氧化氢利用率和产品纯度的影响,确定了*佳工艺条件,实现了过氧化钙在常温下的合成。
资料整理编辑:
《石灰产业》编辑部
2024年07月29日